
بازده درصدی مواد
در بسیاری از واکنش های شیمیایی برای تهیه مواد شیمیایی، معمولاً مقدار فراورده به دست آمده از واکنش در شرایط آزمایشگاهی، کمتر از مقدار محاسبه شده است.
مقدار فراورده کمتر معمولاً به علت:
الف) ایجاد واکنش های جانبی در حین انجام واکنش شیمیایی اصلی
ب) اشکال در جداسازی مواد از هم
ج) و یا وجود مواد زود جوش ( یعنی دمای جوش پایین برخی از مواد ) که می تواند باعث کاهش مقدار فراورده مورد نظر باشد.
پس می توان با توجه به این موارد چنین گفت که:
1- در یک واکنش شیمیایی، مقدار فراورده ای که از محاسبه استوکیومتری مورد انتظار است، مقدار نظری نام دارد.
2- در یک واکنش شیمیایی، مقدار فراورده ای که در عمل تولید می شود، مقدار عملی نامیده می شود. شایان ذکر است که معمولاً مقدار عملی از مقدار نظری کمتر است.
3- بازده درصدی یک واکنش را با استفاده از رابطه ی زیر تعیین می شود:


توجه: شیمی دان ها همواره درصدد افزایش بازده ی درصدی واکنش های شیمیایی در صنعت و در آزمایشگاه هستند.

تذکر: در رابطه ی بازده ی درصدی واکنش که در بالا نوشته شده است، همواره صورت و مخرج کسر فوق، یک نوع یکا دارند و خود کمیت در این فرمول متغیر است. یعنی گاهی جرم، گاهی حجم و گاهی حجم مولی با هم مقایسه می شود و مقدار فراورده هایی که در صورت مسئله داده می شود، همیشه مقدار عملی است.
برای به دست آوردن بازده ی درصدی، مسائل این گروه را به سه دسته عمده تقسیم می کنیم:
دسته ی اول: مسائلی که در آن ها، مقدار عملی داده می شود و بازده ی درصدی مورد سوال است. در این گونه از مسائل، با توجه به مقدار واکنش دهنده ( اگر دو واکنش دهنده وجود داشته باشد، واکنش دهنده ی محدود کننده در نظر گرفته می شود. ) مقدار نظری تولید همان فراورده را با همان یکا محاسبه می شود و با توجه به رابطه بازده ی درصدی واکنش به دست خواهد آمد.
 دسته ی دوم: مسائلی که در آن ها، بازده ی درصدی داده می شود و مقدار عملی باید محاسبه شود. در این صورت با توجه به روابط استوکیومتری، مقدار نظری فراورده ی مورد نظر محاسبه می شود و با توجه به رابطه ی بازده ی درصدی مقدار مجهول محاسبه می شود.
دسته ی دوم: مسائلی که در آن ها، بازده ی درصدی داده می شود و مقدار عملی باید محاسبه شود. در این صورت با توجه به روابط استوکیومتری، مقدار نظری فراورده ی مورد نظر محاسبه می شود و با توجه به رابطه ی بازده ی درصدی مقدار مجهول محاسبه می شود.
دسته ی سوم: مسائلی که در آن ها هم مقدار عملی و هم بازده ی درصدی داده می شود که در این صورت مقدار واکنش دهنده مورد سؤال است. در این گونه مسائل، با استفاده از بازده ی درصدی، مقدار نظری محاسبه می شود، در پایان با توجه به مقدار نظری فراورده های مورد نظر، مقدار واکنش دهنده ی لازم محاسبه می شود.
درصد خلوص مواد
در آزمایشگاه شیمی و روی بطری هایی که مواد مختلف در آنها نگهداری می شود، معمولاً درصد خلوص آن ماده نوشته می شود. زیرا به طور کلی موادی که از آن ها در آزمایشگاه یا صنعت از آن استفاده می کنیم خالص نیستند.
اگر روی ظرف نگهداری کلرید سدیم عدد 8/99 % نوشته شده باشد؛ بدین معناست که اگر 100 گرم از این ماده داشته باشیم 8/99 گرم آن کلرید سدیم و 2/0 گرم ناخالصی دارد.
در بسیاری از آزمایش هایی که در صنعت یا در آزمایشگاه انجام می شود، معمولاً برای تهیه مقدار معینی از یک ماده ی خالص، همواره باید مقدار بیشتری از ماده ی خالص واکنش دهنده ی را در نظر بگیریم. درصد خلوص یک ماده مقدار گرم ماده ی خالص درصد خالص درصد گرم ماده ی ناخالص را نشان می دهد. که به صورت زیر محاسبه می شود:
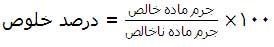
برای حل مسائل درصد خلوص، معمولاً سه حالت زیر پیش می آید:

حالت اول: در این حالت هم جرم ماده ی ناخالص و هم درصد خلوص آن مشخص باشد. در این صورت کافی است جرم ماده ی ناخالص را در درصد خلوص به صورت (a/100) ضرب کنیم.
مثال) مقدار 7 گرم کلرات پتانسیم که دارای خلوص 70% است، تجزیه می کنیم، در این حالت چند مول اکسیژن تولید می شود؟
پاسخ: ابتدا معادله ی تجزیه کلرات پتانسیم را نوشته و معادله ی آن را موازنه می کنیم.
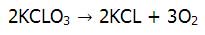
از اطلاعات ارائه شده می دانیم که مقدار KCLO3، هفت گرم می باشد با درصد خلوص 70% و می بایستی مقدار مول تولید شده ی اکسیژن را بیابیم.
به طور کلی مقدار کلرات پتانسیم شرکت کننده در واکنش a از طریق زیر محاسبه می شود.
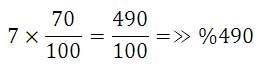
با توجه به جدول تناوبی، جرم مولی مواد تشکیل دهنده ی کلرات پتاسیم، جرم مولی کلرات پتانسیم را می یابیم.
O=16g/mol Cl=35/5g/mol K=39g/mol
g/mol 5/122=16×3+35+ 39= جرم کلرات پتانسیم
با توجه به معادله ی واکنش تجزیه ی کلرات پتانسیم متوجه می شویم که بازای 2 مول از کلرات پتانسیم، 3 مول اکسیژن به دست می آید؛

پس بازای تجزیه 7 گرم کلرات پتانسیم 70 % ، 06/0 مول اکسیژن آزاد می شود.
حالت دوم: در برخی از مسائل ممکن است درصد خلوص ماده ای داده شده باشد و جرم آن مطلوب مسئله باشد. در این صورت می بایستی بعد از حل مسئله؛ درصد خلوص را به صورت 100/a در جرم مولی ضرب شود.
حالت سوم: حالتی است که در آن مسائل، جرم ماده ی ناخالص معلوم باشد ولی درصد خلوص آن مورد سؤال باشد. در این صورت می بایستی روابط استوکیومتری جرم ماده خالص را محاسبه کرده و سپس با توجه به رابطه ی زیر، درصد خلوص ماده را می یابیم.
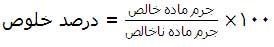
برچسب های مهم